 全球辅助生殖一站式平台 19919999145
全球辅助生殖一站式平台 19919999145 电话:19919999145
微信:17027022222
邮箱:kf@daiyun.cn
地址:国内、马来西亚、吉尔吉斯斯坦
发布时间:2022-04-15 点此:785次

人造子宫的创想最早来自于英国的进化生物学家J.B.S. Haldane,他预测到2074年,约70%的婴儿将是体外孕育诞生的。
目前女性的妊娠过程中,在子宫中孕育的胎儿通过胎盘、脐带与母体进行物质交换,获得营养物质和氧气。扁圆形的胎盘靠近胎儿的一面附有脐带,脐带与胎儿相连,胎盘靠近母体的一面与母体的子宫内膜相连。
胎盘内有许多绒毛,绒毛内有毛细血管,这些毛细血管与脐带内的血管相通。胎儿自己制造血液,血液通过脐带中的血管流到胎盘。绒毛与绒毛之间则充满了母体的血液,胎儿和母体通过胎盘上的绒毛进行物质交换,胎儿的废物则通过滋养层进入母亲的血液,最后被排出母体。
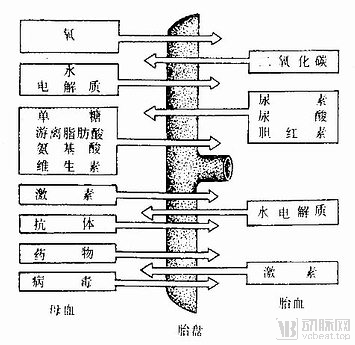
图一 胎盘循环 图源网络
理想上,人造子宫用子宫内羊膜腔环境的无菌流体温育,有类似于脐带-胎盘系统的先天胎儿循环驱动的血液循环和气体交换,以供给胎儿养分和氧气,还可以模拟自然子宫的无菌、温暖和富有弹性的条件。
人造子宫在短、中、长期都具有重大的意义。
在短期,人造子宫旨在通过模拟真实子宫的情况来提升早产婴儿的生存机会和生存质量。截至2020年,全世界新生儿的主要死亡原因是早产。
具体来讲,超过70%的早产儿出生在妊娠34至36周之间,余下的早产婴儿中,在妊娠22周之前出生的婴儿几乎没有生存的机会,妊娠22-23周出生的婴儿仅能获得0.07%的存活率,妊娠23周时出生的婴儿中,约三分之一能够存活,进入24周后,生存几率翻倍,存活率可上升到约60%。
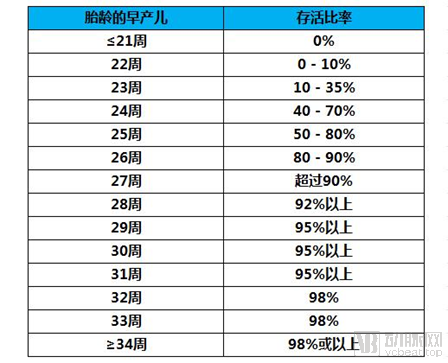
图二 早产儿死亡率
目前有专门的新生重症监护病房,可通过药物、机械通风、液体和电解质管理以及外科手术等措施对早产婴儿进行治疗从而改善早产结局,但是成功率有限。这些存活下来的早产儿的呼吸系统、神经系统、消化系统尚未发育完全。
更有研究表明,现有的治疗手段会进一步的损伤肺部发育甚至会导致心力衰竭。大多数的幸存者都会出现常见的并发症,特别是对妊娠22-28周出生的早产婴儿,在26周前基本上不可避免出现并发症,其中约80%的早产婴儿会患有至少一种重大合并症,如肺部疾病、脑瘫以及听力和视力障碍。
此外,治疗费用也是不容忽视的问题,新生儿重症监护病房的费用是昂贵的,以美国为例,每天每位重症监护病房中的早产婴儿平均费用超过3000美元,如果长期逗留则可能超过一百万美元,这意味着妊娠23周出生的新生儿的父母要做出艰难的抉择。人造子宫的出现有可能改善这些早产婴儿的结局,从而消除新生儿父母的情感困扰。
在中期,人造子宫可以解决不孕不育患者的生育难题。全球约8%~12%的育龄人口面临不孕不育的难题,我国更是超过了4000万人,且人数逐年攀升。
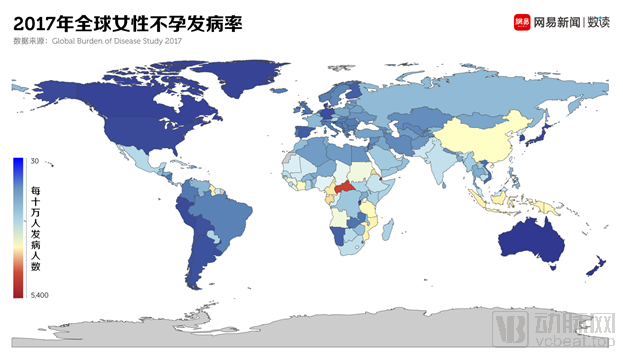
图三 2017年全球女性不孕发病率 图源:网易新闻
目前有10%~20%的患者会求助于辅助生殖(人工授精或试管婴儿),现今社会,受到生活压力和成本的影响,育龄女性的生育意愿降低。当有了一定的财富积累时,部分女性又错过了育龄。在我国,高龄产妇的生育率明显上涨。
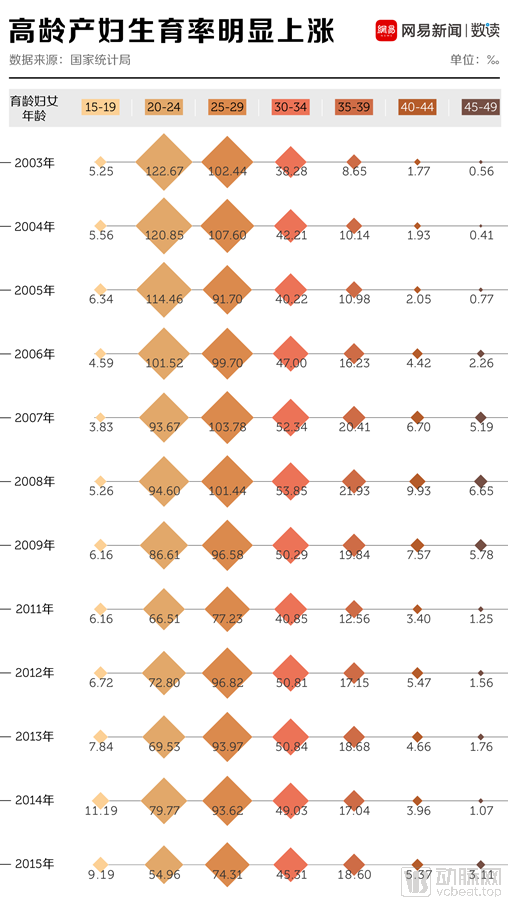
图四 2013-2015年不同年龄段女性生育率 图源:网易新闻
而高龄孕妇辅助生殖治疗的成功率和活产率都显著降低,根据统计,辅助生殖的成功率与患者年龄有极大关系。相较35岁以下患者,38至40岁患者的辅助生殖活产率下降50%,44岁以上患者只有1%。因此,辅助生殖并不是一个万能的手段。
子宫移植是另一个解决手段,子宫虽然免疫排斥相较于其他器官较弱,但是供体大多数来自于受体的母亲和其他亲属,因此在伦理层面饱受争议。从移植技术来看,子宫移植血管的选取、切取和吻合都存在一定的困难,且术后会使得子宫血管进一步变细,可能引发妊娠高血压并导致胎儿生长受限。
2019年1月,我国才有首例子宫移植并胚胎移植出生的婴儿诞生,子宫移植的手术成熟度依旧不高。此外在现阶段,医疗资源分配不均并且由于医保缺位,整个流程下来费用十分昂贵,这也限制了子宫移植在辅助生殖中的临床应用。人造子宫的出现有可能解决育龄女性不孕不育以及非育龄女性的生育问题。
在长期,人造子宫有望在一定程度上解放女性,推动更广泛意义的社会性别平等。自然怀孕和半自然怀孕的成本主要由女性直接承担,怀孕对女性的生活、就业造成显著不同于男性的影响。目前不少现代女性会选择冻卵以推迟生育,但是冻卵后怀孕成功的成功率只有12%,并且冻卵中取卵以及日后怀孕的过程依旧对女性身体造成了伤害。
代孕是其中一种解决手段,但代孕本质上是一种恶劣的阶级剥削,它将无产阶级女性的子宫直接标价为商品在市场出售。如果胎儿能在工业级别的人工子宫中发育,在生殖过程中男女之间的不公平分工则可以被打破,女性将不再单独承担生育的成本。
追溯历史,生育技术一直在进步,从人工授精、配子移植发展到体外授精、胚胎移植。其中从第一代的体外授精胚胎移植发展到第三代的胚胎植入前遗传学检查,到最新出现的三亲婴儿,其利用父亲精子的细胞核DNA、母亲卵子的细胞核DNA以及母亲卵子中独立于细胞核的线粒体DNA,使得线粒体缺陷的女性实现生下健康婴儿的可能。在整个技术更新迭代的过程中,公众的认知和接受程度不断提升,驾驭技术的信心也在增长,给日后人造子宫的大范围推广奠定了很好的基础。
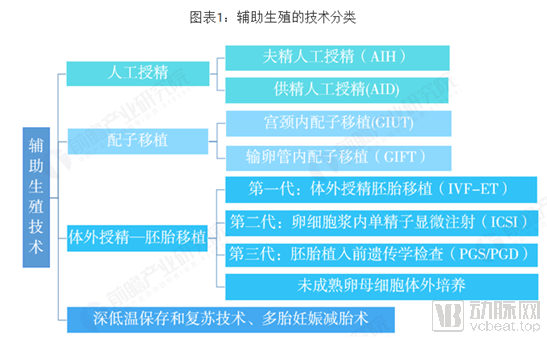
图五 辅助生殖技术分类 图源:前瞻产业研究院整理
人造子宫的雏形可以追溯到1954年,Emanuel M.Greenberg等人申请了人造子宫的专利,设计的人造子宫装置包含一个装有羊水的胎儿罐、连接脐带的机器、血泵、人工肾和热水器。
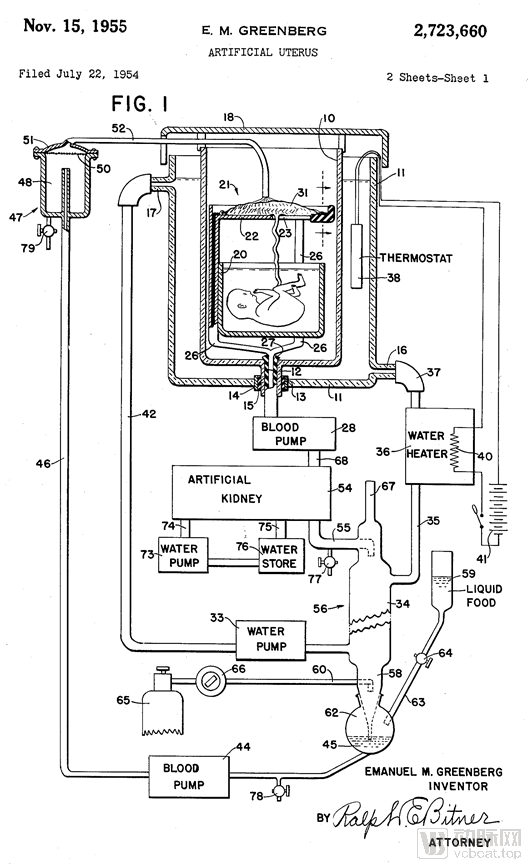
图六 第一份人造子宫专利
1963年,研究人员将流产的山羊胎儿放进氧气舱中,并在里面加入了水一样的液体,其中,通过脐带管对胎儿羔羊进行插管,并通过第一代气泡膜充氧器进行灌注,其总支持时间为40分钟至2天。这些开创性的实验最终受到败血症,电路和氧合器相关并发症以及心力衰竭的限制,并未获得成功。
1996年,东京大学通过剖腹产取出了正常发育了4个月的山羊胚胎,将其放入了加满了羊水的丙烯酸盒子中,山羊胚胎的脐带连接到了人造胎盘上,大多数的胚胎因为机械泵破坏了脆弱的心肺系统死掉了,有几只成功地保持在系统中三周,但他们全部都患有并发症、畸形或者肺部有损伤,实验最终以失败告终。
近些年来,各国有各种科研政策拨款支持仿生学的研究,其中欧盟的“地平线2020计划”,在2019 年 10 月,更是专门拨款 290 万欧元(约合人民币 2320 万元)支持人造子宫的研究。
人造子宫的未来取决于生物工程和材料学的进步,如何更好的模拟孕期女性子宫的环境是发展的方向,目前需要的有如下几个组件:
1. 人造胎盘:人造胎盘是一种更适用于新生儿或早产儿的体外膜肺氧合系统,是抢救垂危胎儿生命的新技术,让他们好像依然待在子宫中。
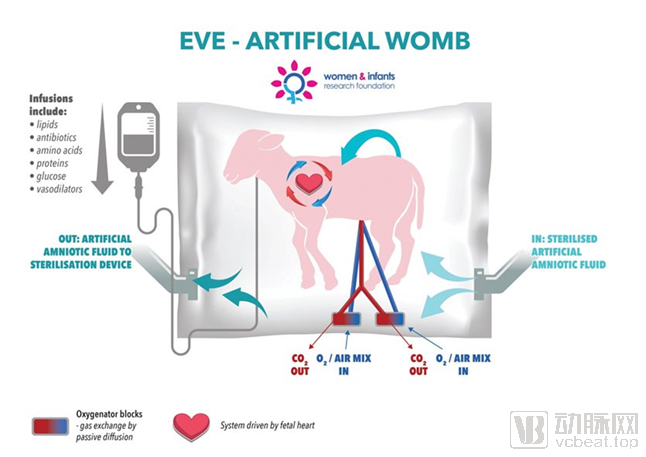
图七 人造胎盘示意图
早前用的充氧器的阻力和泵的支持回路会对胎儿的心脏造成了预负荷或后负荷失衡进而导致进行性循环衰竭。现在的充氧技术有了实质改进,可以通过采用常规的泵驱动ECMO电路,把宫外胎儿生命支持的期限延长到几个星期。但是这最终依旧受循环超负荷和心脏衰竭的限制。
人造子宫中,气体交换的理想界面允许胎儿维持与完整胎儿脐带-胎盘单元类似的循环,并通过胎儿的心输出量确定充氧器的灌注。所以说,研究的重点是新颖的电路设计。通常采用无泵回路与阻力低的充氧器相结合,尽可能的模仿正常的胎盘循环。
与传统的ECMO技术相比,简化的小体积无泵型动静脉回路具有多个优点:包括减少的灌注和分配体积,血液在血栓形成表面的暴露时间缩短以及通过胎儿心脏本身实现对血流和系统性压力的更多生理调节的潜力。
虽然无泵系统已被接受作为理想的技术来实现胎儿生理的保存,但是在动物模型中动物还是会出现代谢性酸中毒、进行性低血压等症状。它们不能复制正常的胎儿肺生理或维持正常的胎儿循环。
2. 生物袋的构建:胎儿要生存在一种一次性使用的完全封闭的生物袋中,如果出现了液体污染问题,将会引发胎儿的肺部感染,因此在设计过程中应尽可能的解决无菌性、尺寸适应性以及空间和液体体积效率问题,通常生物袋是半透明的,可以更好的监视胎儿。此外生物袋上还要有各种插口,如脐带入口以及充氧器回路入口。此外生物袋还要有温度探头和无菌吸管,能够不断交换羊水、提供所有必要的水和营养。套管充当“脐带”,将所需的营养物质和氧气输送到胎儿的血液中。这模仿了正常的胎盘循环,确保了足够的氧气和安全的血压。插管后,将生物袋密封并转移到可移动的支撑平台上,该平台具有温度和压力调节功能,填料,储液罐和流体交换电路。
3. 亚生理循环流的构建:正常胎盘的血流量为150–200 mL / kg / min,如果采用颈动脉插管,受到颈动脉血流的固有局限性,我们只能达到70–100 mL / kg / min。这导致必须进行许多非生理补偿,以使氧气输送与氧气消耗相匹配。这些措施包括向成人血液中输血至更高的血红蛋白水平,维持较高的后膜PaO 2,并使用镇静剂以减少胎儿的氧气消耗。但在胎儿进行手术以放置和取出插管中,颈总动脉的二次结扎及其对脑血流和脑部发育的潜在影响,还可能面临潜在的血管生成障碍。
如果用脐带血管,会产生脐带血管痉挛和血管的侵蚀或动脉瘤变性。此外通过脐带血管进入了中央循环系统会增加了通过电路的阻力,这也阻止了生理电路的流动。此外,由于人的脐动脉曲折,对于没有明显风险的大插管来说,不可能将其插入主动脉。最新的进展是在插管尖端和腹壁之间保持一定长度的天然脐带,这样最大程度地减少了因扭结或成角度而导致的脐带闭塞的可能性,防止了脐带血管的任何变质。最重要的是,允许真正的生理性“胎盘”血流。脐带插管可为多达4周的极早产羔羊(妊娠105至110天)提供稳定的支持,其循环流量相当于胎盘的正常生理流量,并在预期的标准范围内生长,输送氧气和器官成熟。每日超声心动图检查证实胎儿心脏循环维持良好,心脏收缩力和功能良好。
近些年来科学家们在不断尝试着人造子宫的构建,取得的主要进展有:
2001年,康奈尔大学的华裔教授刘鸿清最早开始进行人造子宫的研究。她以人体子宫内膜细胞为基础培养单片人体组织,初步构建了人造子宫的模型:用可生物分解的胶原和软骨素构建子宫形状的支架,之后在支架上种植子宫内膜细胞。经过一段时间的培养,支架自然分解,其上的子宫内膜组织即生长为简易的人造子宫。该子宫可以实现人类受精卵的着床,但因为伦理原因,刘教授在受精卵种植后第六天终止了实验。而后续的小鼠实验证实,该简易子宫虽然可以实现受精卵着床,但远不足以维系后续胚胎的正常生长。
2017 年 4 月,美国费城儿童医院用了外部人造子宫系统,使用山羊胎儿,将其放入装有人工羊水的密封袋子中,胎儿的脐带连接在袋子外面的机器上,促进其生长并防止其免被感染,用三个套管将脐带连接到位于袋子外部。这套设备有无泵动静脉回路,试验中采取体外膜氧合(ECMO)系统为胎儿提供血液循环支持,充分模拟子宫的内部环境,使受试羔羊的心跳控制血液循环。因不依赖机器泵促进胎儿血液循环,具有连续流体交换功能的封闭流体环境和脐静脉血管通路,在体外支持早产羔羊胎儿28天,刷新了胚胎的体外生存时间记录。这类装置如果能应用于临床,将大大提高早产儿的生存率。
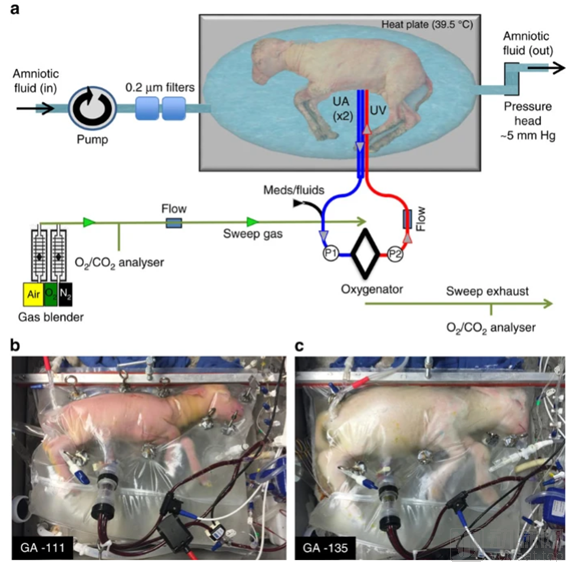
图八 人造子宫中的早产羔羊
2019年,Usuda等人利用离体子宫环境(EVE),在他们2017年发表的生物袋研究基础上进行了四点改进,以挑战现有的早产儿的生存边界:
(1) 对电路的体积(从70 mL至50mL)进行了改进,并调整了电路增强的气体交换,使用了高性能膜氧合器;
(2) 采取了使用半封闭系统,该系统装有小体积的合成羊水浴(从约35 L减少到6 L);
(3) 经常用紫外线消毒的合成羊水更换浴组件(每6小时一次);
(4) 终止颈动脉和颈静脉导管以减轻对胎儿的压力。
这种新型的EVE平台可维持羔羊胎儿的时间更长,发病率和死亡率更低。将早产的羔羊(相当于人类妊娠的24周)密封在无菌塑料袋中的温暖羊水浴中,通过与脐带血管相连的膜式充氧器进行气体交换,可持续120小时,证明了离体子宫环境疗法可以延长晚期早产儿生存的可行性。
尽管EVE研究的存活率为87.5%,但还是存在局限性和不确定性,比如在尸检过程中发现了肾积水伴膀胱扩张、脑损伤,并且有几位受试者显示出肝功能障碍的早期迹象。
2020年,美国维克森林再生医学研究所(WFIRM)宣布,使用生物工程技术制造的子宫组织能够成功修复兔子子宫,使其产下存活后代。他们开发了一种生物可降解高分子材料搭建子宫,并接种了自体细胞进行体外培养。研究者从每只兔子的子宫结构中提取细胞,以培养再生子宫组织和对支架进行接种。进行支架植入手术六个月后,兔子与可育的雄性兔子自然交配。实验表明,在植入 6 个月后,组织工程子宫发育出与天然组织相近的结构,包括腔上皮和腺上皮、有血管的黏膜、双层子宫肌层等。人工子宫内膜厚度低于正常子宫,但膜腺体密度、新生血管数与正常子宫相近。在三个实验组中,只有植入接种了细胞的支架的兔子成功怀孕,足月分娩并产下存活后代。
但是将人造子宫用于人类婴儿还有很长的路要走,在技术层面上仍面临着很大的挑战。
首先,目前人造子宫早在最前的EVE平台,使用的是羔羊最为受试体,羔羊与人的生理构造有很大的不同,在发展到人类试验前,对灵长类动物等进行生理测试是必须的。
其次,不同周龄的胎儿大小和发育尚存在巨大差异。尺寸差异很重要,因为一个较小的婴儿不会抽太多的血液。如果没有足够的血液流过人造子宫的管道,血液将凝结。即使设备可以支持较低的血流,也无法将其连接到如此小的婴儿。人造子宫的插管必须与婴儿的血管相连,但是婴儿越小,其血管就越小。如果血管不够厚,无法稳定插管。总体来讲,婴儿血管的直径限制了人造子宫的发展,对于现今22-24周存活率较低的新生儿来讲,现有的技术可能还是无法使用人造子宫,而对于24周以上的新生婴儿,其本身的生存率已经有60%,人造子宫是否能取得更高的收益依旧是个谜题。
随着技术的再发展和应用,人造子宫的价格降低,变成工业级别的生产设备,越来越多的人将有条件使用,从某种程度上减轻了父母的责任。现代社会的生育和养育准则对父母提出了更高的要求,也给父母带来了更多的社会和经济压力,农业社会的生育和养育方式不一定适合现代社会,社会化生育也是可考虑推行的方式。对此,可能会出现舆论批评,认为工业级别的人造子宫是技术进步导致集体对家庭权利的侵蚀。